
Gene-Drive-Systeme
Genetische Grundlagen von CRISPR/Cas9-basierten Gene-Drive-Systemen
Bereits seit Ende der 1920er Jahre beobachten Wissenschaftler, dass in einigen Arten bestimmte Eigenschaften häufiger vererbt werden, als es nach den Mendelschen Vererbungsregeln zu erwarten wäre. So kann es zum Beispiel nach Verpaarung bestimmter Mücken zu einer fast ausschließlich männlichen Folgegeneration kommen (vgl. Abb.). Die Verbreitung einer Eigenschaft kann hierbei, wie das Beispiel zeigt, auch nachteilig für die Art sein. Die biologischen Mechanismen, die solchen „egoistischen“ Genen (selfish genetic elements) oder auch Gene-Drives zugrunde liegen, sind vielfältig.
Einer der Mechanismen basiert auf sogenannten zielgerichteten Endonukleasen (homing endonucleases), die in der Zygote oder auch später in der Keimbahn aktiv werden. Diese Enzyme sind in der Lage, im Erbgut eines Organismus eine bestimmte, zum Beispiel nur einmal vorkommende Sequenz zu erkennen und in dieser einen gezielten Doppelstrangbruch in die DNA einzuführen. Dieser Strangbruch kann anschließend natürlicherweise auf zwei unterschiedliche Arten repariert werden.
Zum einen können die beiden Strangenden direkt wieder zusammengefügt werden. Diese nichthomologe End-zu-End-Verknüpfung (non-homologous end joining) führt jedoch häufig zum Verlust von einigen Basenpaaren oder zum Einbau zusätzlicher Basenpaare. Die Reparatur kann daher eine Mutation am Ort des ursprünglichen Doppelstrangbruchs verursachen.
Im Gegensatz hierzu erlaubt der zweite Mechanismus, die Homologie-basierte Reparatur (homology-directed repair), eine wenig fehleranfällige Reparatur. Diese Art der Reparatur macht sich zunutze, dass die gesamte Erbinformation in einer Zelle zumeist in zwei Kopien vorliegt. Der Doppelstrangbruch kann somit mit der Kopie als Vorlage repariert werden. Ist in dieser Vorlage jedoch genau an der gebrochenen Stelle ein zusätzlicher DNA-Abschnitt integriert, wird dieser bei der Reparatur auf die andere Kopie überschrieben.
Zielgerichtete Endonukleasen können sich diesen zweiten zelleigenen Reparaturmechanismus zunutze machen, um das für sie kodierende Gen zu verbreiten. Unter der Voraussetzung, dass das Endonuklease-Gen von Sequenzen flankiert wird, wie sie auch in der Umgebung des Doppelstrangbruches vorkommen, führt die Homologie-basierte Reparatur zum Einbau einer Kopie des Endonukleasegens in Chromosomen, welche das Gen ursprünglich nicht enthielten. Ist die Information für eine Endonuklease beispielsweise ursprünglich auf dem mütterlichen Chromosom enthalten, nicht jedoch auf dem väterlichen, kommt es nach Doppelstrangbruch im väterlichen Chromosom durch diese Art der Reparatur zur Kopie des Endonukleasegens in die entsprechende Region des väterlichen Chromosoms. Da nun beide Chromosomen das Gen enthalten, wird es auf alle Nachkommen vererbt. Dies führt schließlich, zumindest theoretisch, zur vollständigen Verbreitung des Gens in der Population innerhalb weniger Generationen.
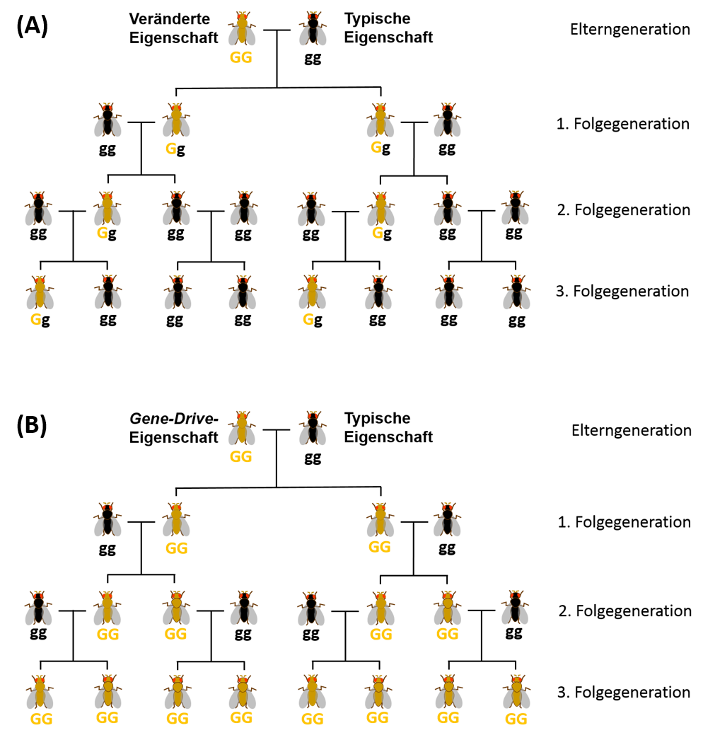
Vererbung gemäß Mendel (A) bzw. eines Gene-Drives (B). Der jeweilige Genotyp, G (gelb) oder g (schwarz), ist unterhalb der Fliegen angegeben. (A) Die veränderte Eigenschaft (gelb) ist der dominante Phänotyp. (B) Die veränderte Eigenschaft (gelb) ist an einen Gene-Drive gekoppelt.
Schon in den 1960er Jahren wurde erkannt, dass die Effekte einer solchen Vererbung per Gene-Drive zum Beispiel für die Kontrolle krankheitsübertragender Mücken genutzt werden könnten. Technisch realisierbar wurde der gezielte Einsatz von Gene-Drives jedoch erst durch die Entwicklung des CRISPR/Cas9-Werkzeugs im Jahr 2012. Dieses erlaubt zum Beispiel einen Doppelstrangbruch nur an einer einzigen spezifischen Stelle im Genom zu erzeugen. Das Werkzeug macht sich zwei Komponenten eines bakteriellen Systems zur Abwehr von Viren zunutze. Zum einen ist dies eine Endonuklease (Cas9) und zum anderen ein kurzes RNA-Molekül (guide-RNA oder sgRNA), welches die Endonuklease zu einer bestimmten Zielsequenz leitet. Der CRISPR/Cas9-basierte Gene-Drive stellt damit eine biotechnologische Nachahmung der oben beschriebenen, in der Natur vorkommenden zielgerichteten Endonukleasen dar. Nach jetzigem Kenntnisstand ist er der am einfachsten einsetzbare Gene-Drive. Entsprechend der natürlichen Vielfalt von Gene-Drive-Mechanismen sind jedoch auch weitere Systeme mit anderen Bestandteilen denkbar.
Wie durch natürliche Gene-Drives kann eine Eigenschaft einer Population auch mittels biotechnologisch erzeugter Gene-Drives neu eingeführt, verändert oder entfernt werden. In der Regel wird hierzu neben den beiden Bestandteilen des CRISPR/Cas9-Werkzeugs ein weiteres, sogenanntes Fracht-Gen (cargo gene) passiv mit verbreitet. Dieses Gen ist letztlich für die Veränderung einer Eigenschaft des Organismus verantwortlich.
Im Gegensatz zu Verfahren der Genom-Editierung, welche sich ebenfalls das CRISPR/Cas9-Werkzeug zunutze machen können, unterliegt eine durch Gene-Drives eingeführte Veränderung nicht den Mendelschen Vererbungsregeln. Gene-Drive und Genom-Editierung unterscheiden sich demnach grundlegend von einander, auch wenn sie auf denselben molekularen Werkzeugen basieren können. Die beiden Methoden sollten daher nicht gleichgesetzt werden.
Anwendungsmöglichkeiten von Gene-Drive-Systemen
In der Anwendung von Gene-Drives kann prinzipiell zwischen zwei Formen unterschieden werden. Zum einen kann ein Gene-Drive dazu genutzt werden, eine Population gezielt zu dezimieren. Dieser sogenannte suppression drive wird dadurch erreicht, dass in das Geschlechterverhältnis der Nachkommen oder ihre Fortpflanzungsfähigkeit eingegriffen wird. So könnte ein Gene-Drive zum Beispiel die Unfruchtbarkeit eines Großteils der männlichen Nachkommen verursachen oder zur bevorzugten Vererbung eines der beiden Geschlechtschromosomen führen. Der zweite Ansatz, der mittels Gene-Drive verfolgt werden kann, ist die gezielte Veränderung von Eigenschaften eines Organismus mithilfe eines sogenannten alteration drive, ohne dabei seine Vermehrungsfähigkeit zu vermindern. Hierbei ist besonders die Möglichkeit, die Übertragung eines bestimmten Krankheitserregers zu verhindern, von Interesse. Es wäre zum Beispiel denkbar, dass in einen Organismus ein Gen neu eingeführt oder so verändert wird, dass ein Virus diesen Organismus nicht mehr als Wirt nutzen kann.
Unabhängig von der Anwendung ist ein funktionierender Gene-Drive an bestimmte Voraussetzungen geknüpft. So muss sich der Zielorganismus sexuell vermehren. Aus praktischen Gründen sollte der Zielorganismus auch über eine möglichst kurze Generationszeit verfügen, da es mehrere Generationen dauert, bis sich eine genetische Änderung innerhalb einer Population durchgesetzt hat. Gemäß diesen Voraussetzungen ist ein erfolgreicher Einsatz eines Gene-Drives auf bestimmte Tiere und Pflanzen beschränkt. Gegenwärtig wird sein Haupteinsatzgebiet in der Veränderung von Insekten- und Nagetierpopulationen gesehen.
Darüber hinaus können auch weitere Faktoren über die Anwendbarkeit eines Gene-Drive-Systems bestimmen. Erste Laborstudien haben zum Beispiel gezeigt, dass im Zielorganismus relativ schnell eine Resistenz gegen den CRISPR/Cas9-basierten Gene-Drive entstehen kann. Ursache für die Resistenz ist die Nutzung des „falschen“ Mechanismus für die Reparatur des eingefügten Doppelstrangbruchs. Kommt es nämlich nicht zur Homologie-basierten Reparatur, sondern zur nichthomologen End-zu-End-Verknüpfung, wird häufig eine Mutation innerhalb der Erkennungssequenz der Endonuklease erzeugt. Die Sequenz ist daraufhin für die Endonuklease nicht mehr erkenn- und schneidbar. Die genetische Information für den Gene-Drive kann daher nicht in Chromosomen mit einer solchen Mutation hinein kopiert werden. In der Folge kommt die überproportionale Vererbung des Gene-Drives zum Erliegen. Resistenzbildung würde daher eine Verbreitung der beabsichtigten Veränderung innerhalb einer Population verhindern oder wenigstens erschweren. Der Gene-Drive würde damit möglicherweise nicht die gewünschte Wirkung erzielen. Je nach den spezifischen Eigenschaften eines Gene-Drive-Systems variiert die Häufigkeit, mit der Resistenzmutationen entstehen. Häufigkeiten von bis zu 50 % wurden bereits beschrieben. Dies entspricht den Beobachtungen natürlicher Gene-Drive-Systeme, zum Beispiel bei Insekten, in denen Resistenzen gegen Gene-Drives sehr häufig entdeckt wurden.
Konkret dominieren zurzeit zwei potenzielle Anwendungsgebiete die Forschung und Diskussion zu Gene-Drive-Systemen. So sollen diese Systeme zukünftig zum einen der Eindämmung von durch Insekten übertragbaren Krankheiten wie zum Beispiel Malaria, Dengue- oder Gelbfieber dienen. Um dieses Ziel zu erreichen, werden beide der oben beschriebenen Ansätze verfolgt. Es sollen hierbei einerseits die Populationsgrößen der wenigen Mückenarten, die die entsprechenden Krankheitserreger übertragen, reduziert werden. Anderseits soll auch die Vermehrung der Krankheitserreger in diesen Arten unterdrückt werden. Das zweite Anwendungsgebiet ist der Schutz bedrohter heimischer Ökosysteme durch die Bekämpfung invasiver Tier- und Pflanzenarten. Hierfür sollen suppression drives eingesetzt werden, die zum Zusammenbruch der Populationen invasiver Arten führen. Dabei wird angenommen, dass Gene-Drive-Systeme eine effektivere und gezieltere Lösung zur Erhaltung der natürlichen Vielfalt darstellen als die gegenwärtig genutzten Pestizide, Fallen und Giftköder. Es bleibt allerdings anzumerken, dass die Frage, wie ein Gene-Drive auf eine territoriale Region begrenzt werden kann, zurzeit nicht geklärt ist.
Bewertung von Gene-Drive-Systemen
Um als Gene-Drive zu funktionieren, muss die genetische Information wenigstens eines Fremdgens, zum Beispiel eines Endonukleasegens, in das Genom des Ausgangsorganismus eingebracht werden. Der resultierende Organismus, wie auch alle anderen Organismen auf die der Gene-Drive durch diesen übertragen wird, sind demnach gentechnisch verändert. Die Konstruktion von Gene-Drive-Systemen sowie der Umgang mit ihnen unterliegen damit zwingend den nationalen und internationalen Gentechnikgesetzgebungen. Es handelt sich also zwar um eine vergleichsweise neue Methode, ihre Entwicklungsverfahren und Produkte werden jedoch – anders als oftmals dargestellt – bereits reguliert und überwacht.
Mit der Novellierung der deutschen Gentechniksicherheitsverordnung (GenTSV) im Jahr 2019 hat der Gesetzgeber festgeschrieben, dass gentechnische Arbeiten, die darauf abzielen, genetische Elemente herzustellen, die die eigene Ausbreitung in Populationen sich sexuell vermehrender Organismen vorantreiben, zunächst der Sicherheitsstufe 3 zuzuordnen sind . Dies hat zur Folge, dass für Arbeiten mit Gene-Drive-Systemen zwingend ein Genehmigungsverfahren bei der jeweiligen für Gentechnik zuständigen Landesbehörde durchlaufen werden muss. Im Rahmen dieses Genehmigungsverfahren ist die Landesbehörde verpflichtet, eine Empfehlung der Zentralen Kommission für die Biologische Sicherheit (ZKBS) hinsichtlich der Sicherheitsmaßnahmen einzuholen, die bei der gentechnischen Arbeit eingehalten werden müssen. Da für die Sicherheitsbewertung eines Gene-Drive-Systems Kriterien berücksichtigt werden müssen, die nicht nur die genomische Veränderung des Individuums betreffen, sondern zum Beispiel auch mögliche Umweltauswirkungen bei einer unbeabsichtigten Freisetzung, ist eine Bewertung nur im Einzelfall durchführbar.
Die ZKBS gibt unter Beschreibung des konkreten Vorhabens eine Stellungnahme mit einer begründeten Zuordnung zu einer Sicherheitsstufe ab, die durchaus von der vorläufigen Einstufung in die Sicherheitsstufe 3 abweichen kann. Falls erforderlich, gibt sie außerdem besondere technische, organisatorische oder persönliche Sicherheitsmaßnahmen vor. Die Einzelfallbewertung stützt sich dabei auf die beabsichtigten und möglicherweise nicht beabsichtigten Folgen einer Freisetzung des durch den Gene-Drive veränderten Organismus, insbesondere für die Umwelt in ihrem Wirkungsgefüge. Hierbei wird in besonderem Maße das Vorhandensein geeigneter Lebens- bzw. Fortpflanzungsbedingungen in der aufnehmenden Umwelt als Bewertungsgrundlage herangezogen. Die Einzelfallbewertung ermöglicht so die Grundlagenforschung zum Thema Gene-Drive bei einer gleichzeitigen Minimierung des Risikos einer unbeabsichtigten Freisetzung.
Gene-Drive-Systeme stehen erst am Anfang ihrer Erforschung, und es wird sicherlich noch einige Zeit dauern, bis alle grundlegenden Fragen für die jeweilige Anwendung beantwortet werden können. Daher werden gegenwärtig nur Versuche in Forschungslaboren mit entsprechenden Sicherheitsstandards durchgeführt, die eine unbeabsichtigte Freisetzung von durch Gene-Drives veränderten Organismen verhindern. Auf dem Weg zu einer tatsächlichen Anwendung sind jedoch auch Versuche unter weniger künstlichen Bedingungen unabdingbar. Dies kann zum Beispiel in großangelegten Käfigversuchen stattfinden, bei denen ein Ökosystem innerhalb eines für Tiere nicht durchlässigen Käfigs nachgestellt wird. Alternativ könnten auch räumlich begrenzte Freisetzungen auf Inseln erfolgen. Erst wenn mithilfe dieser Versuche ausreichende Daten gesammelt wurden, sind genehmigte Freisetzungen in nicht geografisch isolierten Gebieten vorstellbar.
Bisher wurde der ZKBS eine Arbeit für ein Gene-Drive-System zur Nutzung in einem geschlossenen Forschungslabor zur Bewertung vorgelegt. Das in dieser Arbeit beschriebene System führt erwiesenermaßen häufig zu einer Resistenz gegenüber der verwendeten Endonuklease. Von dem in dieser Arbeit genutzten Gene-Drive-System geht daher keine Gefahr für Mensch, Tier und Umwelt aus und die Arbeit wurde entsprechend der Sicherheitsstufe 1 zugeordnet.
_____________________________________________________________________________________________
* Arbeiten mit gentechnisch veränderten Organismen werden je nach ihrem Gefährdungspotenzial für Mensch, Tier und Umwelt einer von vier Sicherheitsstufen zugeordnet. Der Sicherheitsstufe 1 werden hierbei Arbeiten ohne Gefährdungspotenzial zugeordnet, während der Sicherheitsstufe 4 Arbeiten mit hohem Gefährdungspotenzial zugeordnet werden. Je nach zugeordneter Sicherheitsstufe sind unterschiedlich strenge Sicherheitsmaßnahmen bei den Arbeiten einzuhalten.
Eine gute Übersicht zu Gene-Drives bietet auch das Faktenblatt der Akademien der Wissenschaften der Schweiz.
Weiterführende Literatur (Englisch)
- Werren JH (2011). Selfish genetic elements, genetic conflict, and evolutionary innovation. Proc Natl Acad Sci U S A. 108 Suppl 2:10863-70.
In diesem Übersichtsartikel wird die Funktionsweise verschiedener egoistischer Gene beschrieben. - Thurtle-Schmidt DM, Lo TW (2018). Molecular biology at the cutting edge: A review on CRISPR/CAS9 gene editing for undergraduates. Biochem Mol Biol Educ. 46(2):195-205.
In diesem Übersichtsartikel werden die molekularbiologischen Hintergründe sowie Anwendungsmöglichkeiten des CRISPR/Cas9-Werkzeugs zusammengefasst. - Alphey LS, Crisanti A, Randazzo FF, Akbari OS (2020). Opinion: Standardizing the definition of gene drive. Proc Natl Acad Sci U S A. 117(49):30864-30867.
In diesem Artikel wird auf die Bedeutung einheitlicher Definitionen wichtiger Fachbegriffe in der Gene-Drive-Forschung hingewiesen.
Eine Liste mit kurzen Definitionen häufig verwendeter Fachbegriffe findet sich hier. - National Academies of Sciences, Engineering, and Medicine (2016). Gene Drives on the Horizon: Advancing Science, Navigating Uncertainty, and Aligning Research with Public Values. Washington, DC: The National Academies Press.
Die US-amerikanischen Akademien der Natur- und Ingenieurswissenschaften und der Medizin beschreiben ausführlich die Grundlagen der Gene-Drive-Forschung und erklären Beispiele. Außerdem werden sicherheitsrelevante und ethische Fragen beleuchtet. - Raban RR, Marshall JM, Akbari OS (2020). Progress towards engineering gene drives for population control. J Exp Biol. 223(Pt Suppl 1):jeb208181.
In diesem Übersichtsartikel werden verschiedene Typen von Gene-Drives vorgestellt. - Esvelt KM, Smidler AL, Catteruccia F, Church GM (2014). Concerning RNA-guided gene drives for the alteration of wild populations. eLife. 3: e03401.
In diesem Übersichtsartikel werden die Möglichkeiten, die Gene-Drive-Systeme eröffnen, aber auch ihre Grenzen sowie mögliche Sicherheitsmaßnahmen zusammengefasst. - Gantz VM, Bier E (2015). The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science. 348(6233): 442–444.
In diesem Artikel wird die Entwicklung des ersten Gene-Drives in der Fruchtfliege beschrieben. - Gantz VM, Jasinskiene N, Tatarenkova O, Fazekas A, Macias VM, Bier E, James AA (2015). Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proc Natl Acad Sci U S A. 112(49): E6736–E6743.
In diesem Artikel wird die Entwicklung eines Gene-Drives im Malaria-Überträger Anopheles stephensi beschrieben. - Hammond A, Galizi R, Kyrou K, Simoni A, Siniscalchi C, Katsanos D, Gribble M, Baker D, Marois E, Russell S, Burt A, Windbichler N, Crisanti A, Nolan T (2016). A CRISPR-Cas9 Gene Drive System Targeting Female Reproduction in the Malaria Mosquito vector Anopheles gambiae. Nat Biotechnol. 34(1): 78–83.
In diesem Artikel wird die Entwicklung eines Gene-Drives im Malaria-Überträger Anopheles gambiae beschrieben. - de Jong TH (2017). Gene drives do not always increase in frequency: from genetic models to risk assessment. J Consum Prot Food Saf. 12: 299.
Basierend auf mathematischen Modellen werden in diesem Artikel verschiedene Gene-Drive-Systeme und die Wahrscheinlichkeit ihrer Etablierung in natürlichen Populationen betrachtet. - KaramiNejadRanjbar M, Eckermann KN, Ahmed HMM, Sánchez C HM, Dippel S, Marshall JM, Wimmer EA (2018). Consequences of resistance evolution in a Cas9-based sex-conversion suppression gene drive for insect pest management. Proc Natl Acad Sci U S A. 115(24):6189-6194.
In diesem Artikel wird die Resistenzentwicklung gegen einen Gene-Drive in Fruchtfliegen beschrieben. - Akbari OS, Bellen HJ, Bier E, Bullock SL, Burt A, Church GM, Cook KR, Duchek P, Edwards OR, Esvelt KM, Gantz VM, Golic KG, Gratz SJ, Harrison MM, Hayes KR, James AA, Kaufman TC, Knoblich J, Malik HS, Matthews KA, O'Connor-Giles KM, Parks AL, Perrimon N, Port F, Russell S, Ueda R, Wildonger J (2015). Safeguarding gene drive experiments in the laboratory: Multiple strategies are needed to ensure safe gene drive experiments. Science. 349(6251): 927–929.
In diesem Artikel werden Sicherheitsmaßnahmen verschiedener Ebenen für den Umgang mit durch Gene-Drives veränderten Organismen vorgeschlagen. - Buchman A, Marshall JM, Ostrovski D, Yang T, Akbari OS (2018). Synthetically engineered Medea gene drive system in the worldwide crop pest Drosophila suzukii. Proc Natl Acad Sci U S A. 115(18):4725-4730.
In diesem Artikel wird ein Gene-Drive basierend auf dem Toxin-Antitoxin-System »Medea« beschrieben. - Zhang T, Mudgett M, Rambabu R, Abramson B, Dai X, Michael TP, Zhao Y (2021). Selective inheritance of target genes from only one parent of sexually reproduced F1 progeny in Arabidopsis. Nat Commun. 12(1):3854.
In diesem Artikel wird erstmals ein Gene-Drive in einer Pflanze beschrieben.
erschienen: Juli 2018, Update Dez. 2021